近日,有机电子与信息显示国家重点实验室、必赢3003no1线路检测中心化学与生命科学学院罗志敏教授与南京大学合作,在手性纳米佐剂与肿瘤原位疫苗领域取得最新研究进展。相关成果以“Chiral coordination polymer nanowires boost radiation-induced in situ tumor vaccination”为题发表在国际学术期刊Nature Communications上。

Nature Communications刊发必赢科研团队在手性纳米佐剂与肿瘤原位疫苗领域的最新研究进展
罗志敏教授和南京大学胡一桥教授、袁阿虎教授为共同通讯作者,化学与生命科学学院青年教师黄竹胜和硕士研究生顾榕、黄世前同学为论文共同第一作者,清华大学崔晓亚博士、苏家跃博士和冷冻镜平台刘涛老师给予冷冻透射电镜表征和结构解析的大力支持。
肿瘤的放射治疗相当于接种了内源性原位疫苗,但这种仅由放射治疗引发的内源性原位疫苗的效应非常微弱,几乎不能诱导全身性的抗肿瘤免疫反应。团队基于临床抗病毒药物(单磷酸阿糖腺苷)与核磁造影剂(钆离子)通过配位自组装和相调控技术,开发了手性阿糖腺苷磷酸钆纳米线(aAGd-NWs)来增强放疗诱导的肿瘤原位疫苗效应。在清华大学崔晓亚博士、苏家跃博士和刘涛老师的帮助下,团队通过冷冻透射电镜解析了aAGd-NWs的结构特征,包括超细形貌、表面配位和右手螺旋手性,并阐明了aAGd-NWs手性自组装的机制。在生物机制上,aAGd-NWs不仅增强了X射线沉积和散射,增强放疗的敏感性,而且有效抑制肿瘤细胞DNA的自我修复,有效激活cGAS-STING通路促进I型干扰素的分泌,增加了CD8+ T细胞在肿瘤组织中的浸润。协同免疫检查点阻断疗法显著增强了放疗诱导的原位疫苗效应。
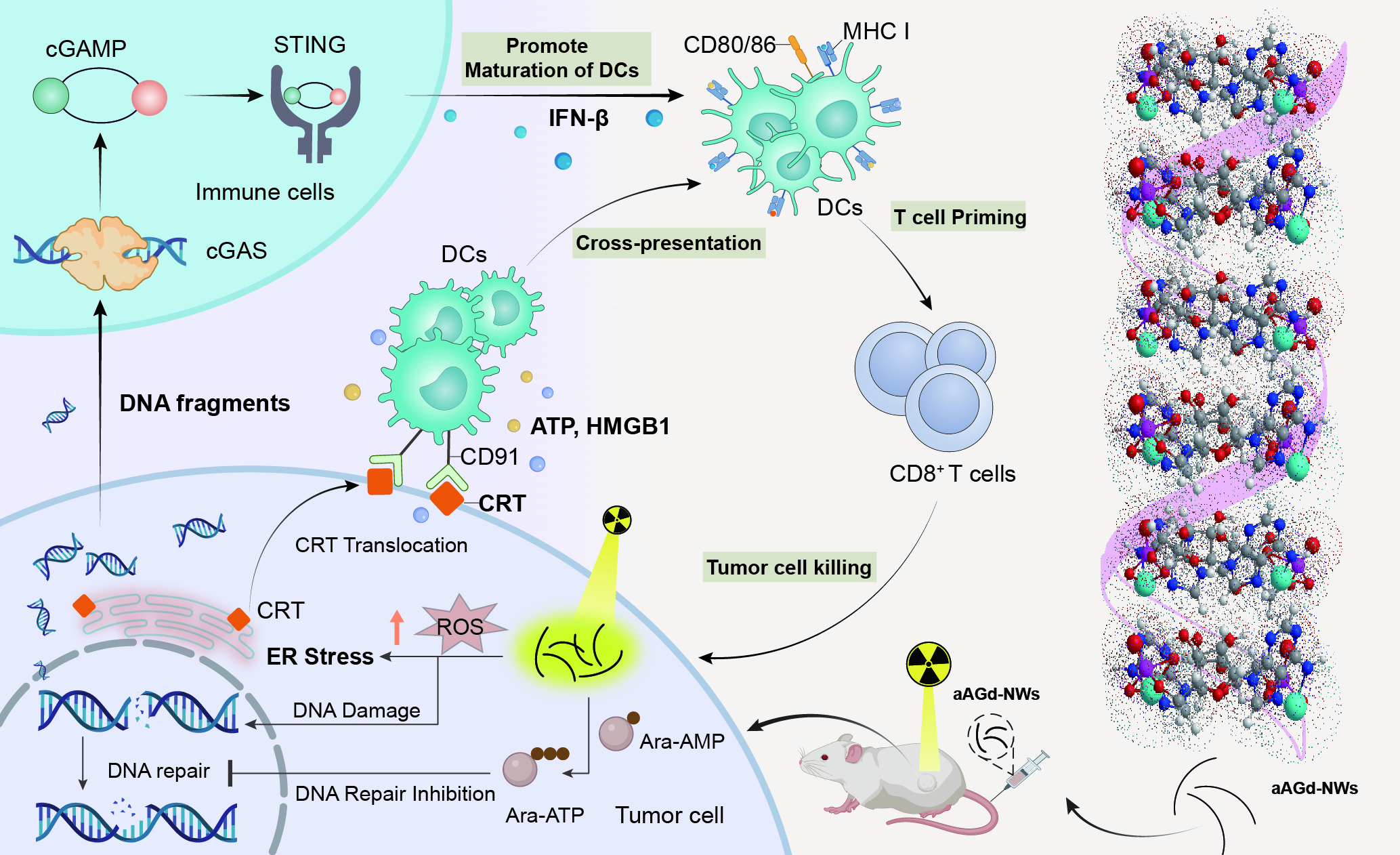
手性配位聚合物纳米线增强放疗诱导的肿瘤原位疫苗效应
冷冻透射电镜的应用为研究新型纳米材料的结构和形成机制提供了新的思路,“老药新用”和“药物自递送”策略为放射免疫疗法和临床转化提供了可能。该工作得到国家重点研发计划,国家自然科学基金,江苏省高校重点、面上项目,有机电子与信息显示国家重点实验室主任基金与必赢3003no1线路检测中心引进高水平师资科研启动经费等项目的支持。
(撰稿:黄竹胜 初审:罗志敏、赖文勇、乔祖琴、蔡志匡 编辑:王存宏 审核:张丰)

